拠点メンバー
福田 光則(細胞生物学)

1996年東京大学大学院医学系研究科博士課程修了。医学博士。1996年日本学術振興会特別研究員(PD)、1998年理化学研究所・脳科学総合研究センター研究員、2002年独立行政法人理化学研究所・福田独立主幹研究ユニットユニットリーダーを経て、2006年より現職。専門は細胞生物学、神経科学。神経細胞における小胞輸送(神経伝達物質の放出など)やメラニン色素の輸送の分子メカニズムの解明に従事。著書に『シナプトタグミンによる調節性分泌の制御』(蛋白質核酸酵素、共立出版、2004年)、『美白への新たなアプローチ―メラニン輸送をストップさせる―』(バイオニクス、オーム社、2005年)など。日本生化学会奨励賞(2004年)、花王研究奨励賞(2006年)、日本分子生物学会三菱化学奨励賞(2007年)などを受賞。
- 5年間の研究のまとめ
-
私達の脳を構成する神経細胞は、軸索と樹状突起という構造物を伸ばし、シナプスを形成することにより神経細胞のネットワークを形成している。軸索の先端には神経伝達物質を詰め込んだシナプス小胞が存在し、ここから放出された神経伝達物質が樹状突起のポストシナプスに存在する神経伝達物質受容体に作用することによりシグナルを伝搬する。このため、神経細胞が機能を発揮するためには、神経突起を正しく伸長すること、また、軸索方向には軸索でのみ機能する分子(例えば、シナプス小胞の輸送に関与する分子)、樹状突起には樹状突起でのみ機能する分子(例えば、ポストシナプスを形成する分子)を輸送することが不可欠と考えられる。これらの分子の多くは膜タンパク質であるため、「小胞(膜)輸送機構」が重要と考えられるが、神経突起伸長や突起方向への極性輸送の分子機構はこれまで十分に解明されていなかった。そこで私達は、膜輸送の普遍的制御因子・低分子量Gタンパク質Rabファミリーに着目し、神経細胞特異的な膜輸送機構の解明に取り組んできた。これまで、リサイクリングされたシナプス小胞の輸送に関わるRabとしてRab27を(PNAS, 2008)、神経突起の伸長を制御するRabとしてRab35を(Traffic, 2010)、また樹状突起やスパインの形成に関与するRabとしてRab17を同定することに成功している(J. Biol. Chem., 2012)。
私達はさらに、メラニン色素を合成するメラノサイトという細胞が、発生学的に神経細胞と同じ神経冠細胞に由来すること、膜輸送という観点から見るとメラノソーム(メラニン色素含有小胞)の輸送は分泌の特殊な形態であることに着目し、メラノサイトの機能解析にも着手した。これまでに、上述のRab27がメラノソームの輸送にも必須であること、神経細胞の突起伸長にも関わるRab38エフェクターVarpがメラノサイトの樹状突起形成に関与することを突き止めた(Mol. Biol. Cell, 2009; 2012)。
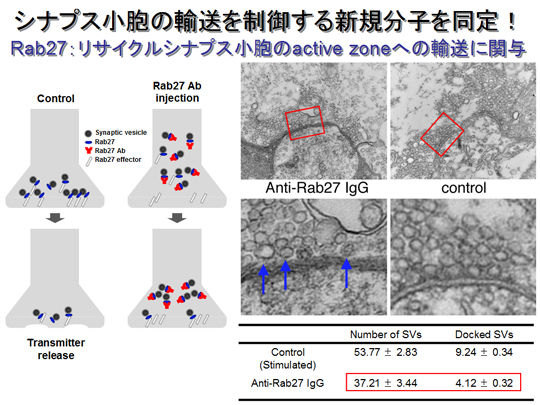
低分子量G蛋白質Rabファミリーは60種類以上のアイソフォームが存在し、脳内においても何らかの特異的な小胞輸送を制御すると考えられている。これまでの研究で、Rab27がシナプス小胞上に存在し、リサイクルされたシナプス小胞を細胞膜まで輸送し、プレシナプス膜につなぎ止める過程に関与することが明らかになった。Rab27に対する機能阻害抗体(赤のY印)をイカの巨大軸索に導入すると、コントロールのシナプスに比べ、シナプス小胞数が減少するだけでなく、プレシナプス膜にドッキングしたシナプス小胞数が顕著に減少していた(青矢印)。
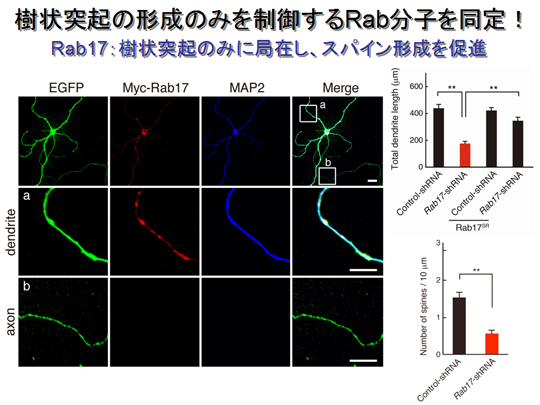
マウスに存在する全てのRabサブファリミーを海馬神経細胞に導入し、検討した結果、MAP2陽性の樹状突起に特異的に局在する唯一のRabとして、Rab17を同定することに成功した(左側、赤と青のシグナル)。Rab17をノックダウンした神経細胞では、軸索形成には影響なく、樹状突起の伸長やbranching、さらにはスパイン形成が顕著に減少することが明らかになった。
- 代表的な論文
-
- Yu, E., Kanno, E., Choi, S., Sugimori, M., Moreira, J. E., Llinas, R. R. and Fukuda, M. (2008) Role of Rab27 in synaptic transmission at the squid giant synapse. Proc. Natl. Acad. Sci. USA 105, 16003-16008
- Tamura, K., Ohbayashi, N., Maruta, Y., Kanno, E., Itoh, T. and Fukuda, M. (2009) Varp is a novel Rab32/38-binding protein that regulates Tyrp1 trafficking in melanocytes. Mol. Biol. Cell 20, 2900-2908
- Kanno, E., Ishibashi, K., Kobayashi, H., Matsui, T., Ohbayashi, N. and Fukuda, M. (2010) Comprehensive screening for novel Rab-binding proteins by GST pull-down assay using 60 different mammalian Rabs. Traffic 11, 491-507
- Itoh, T., Kanno, E., Uemura, T., Waguri, S. and Fukuda, M. (2011) OATL1, a novel autophagosome-resident Rab33B-GAP, regulates autophagosomal maturation. J. Cell Biol. 192, 839-853
- Ohbayashi, N., Maruta, Y., Ishida, M. and Fukuda, M. (2012) Melanoregulin regulates retrograde melanosome transport through interaction with the RILP―p150Glued complex in melanocytes. J. Cell Sci. (doi: 10.1242/jcs.094185)
- Mori, Y., Matsui, T., Furutani, Y., Yoshihara, Y. and Fukuda, M. (2012) Small GTPase Rab17 regulates dendritic morphogenesis and postsynaptic development of hippocampal neurons. J. Biol. Chem. 287, 8963-8973