医科学専攻
Neurochemistry神経化学
STAFF
Professor
-
Ishii, NaotoProfessor. 石井 直人 教授 (兼任)

Other Faculty / Staff
-
Teruya, Kenta
Assoc. Prof. 照屋 健太 准教授
CONTACT
TEL:+81-22-717-8232
E-MAIL:kenta.teruya.d4*tohoku.ac.jp
(「*」を「@」に変換してください)
OUTLINE
Our research interests are basic science and applied medical science related to the diseases caused by misfolded protein accumulation in the brain, including prion disease and prion-like disease (Alzheimer’s disease, Parkinson’s disease, and others). All these incurable brain diseases appear age-dependently in a sporadic or familial fashion and are proposed to share similar pathological pathways in the brain. The nature of misfolded proteins, especially prion, is still one of the most challenging enigmas in science because misfolded proteins transmit the pathological conditions into normal cells, and even into healthy individuals. The goal of our research is both disclosing the molecular mechanism of prion and prion-like diseases and making them curable.
進行性に脳がおかされる神経難病には、タンパク質が異常に折畳まれて凝集物を形成し脳に蓄積する疾患群(プリオン病、アルツハイマー病、パーキンソン病など)があります。いずれも未だに病気の進行を阻止する根本的な治療予防法は見つかっていません。また、タンパク質の異常凝集物が脳でどのように制御され、どうして脳がおかされるのかといった基本的なメカニズムも、十分には解明されていません。さらに、病気の原因であるタンパク質の異常凝集物は、その性質を他の細胞や個体に伝達する能力があり、タンパク質性の形質伝達因子と言えます。核酸を介さない形質伝達はセントラルドグマの唯一の例外で、タンパク質性の形質伝達因子の生物学的な存在意義も良くわかっていません。私達は、折畳み異常タンパク質の代表であるプリオンについて、プリオンがひきおこす病気の治療予防法の探索研究やプリオンに対する生体防御機構の解明研究を行い、治療候補薬の開発を行っています。また、タンパク質性伝達因子に対して阻害活性を持つ化合物や生体因子の作用機序を解析し、プリオンやタンパク質性伝達因子の形質伝達及び形質発現のメカニズムを探っています。
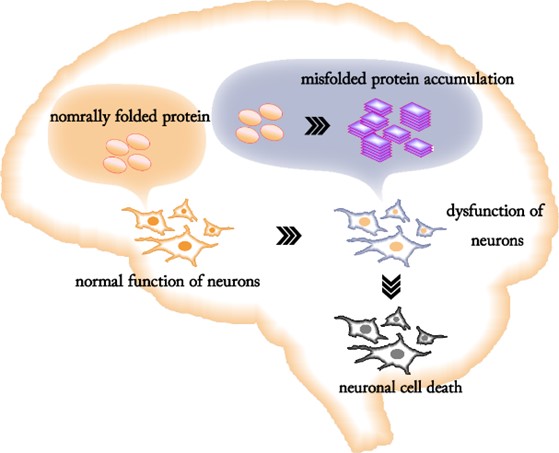
Conceptual pathological pathway of brain diseases caused by misfolded proteins
ミスフォールド蛋白質による神経変性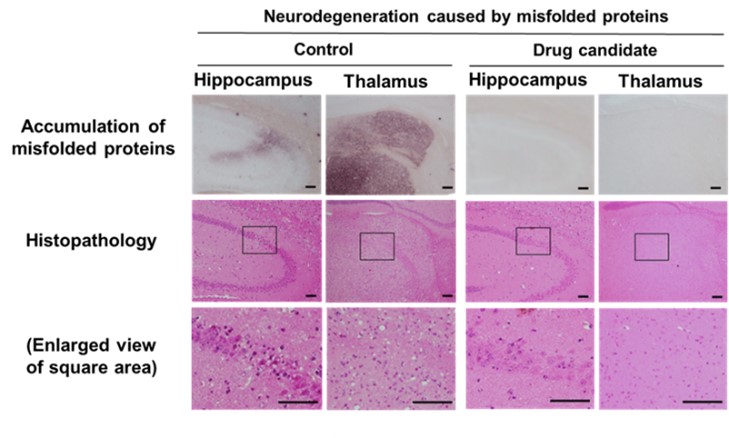
Effects of a drug candidate (modified Fig 1B of recent publication 02)
治療候補薬の効果(発表論文02の図1Bを改変)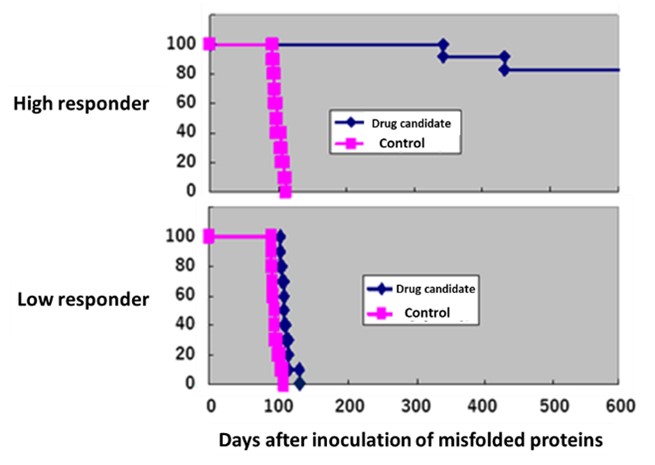
Survival curves indicating different responses to therapeutic treatment
治療に対する感受性の違い示す生存曲線
Lunch party for cherry blossom viewing
花見ランチ
ARTICLE
Teruya K, Doh-ura K. Therapeutic development of polymers for prion disease. Cell Tissue Res, Online ahead of print., 2022
URL:https://pubmed.ncbi.nlm.nih.gov/35307792/
Teruya K, et al. Anti-prion activity of cellulose ether is impaired in mice lacking pre T-cell antigen receptor α, T-cell receptor δ, or lytic granule function. Int Immunopharmacol. 107:108672, 2022
URL:https://pubmed.ncbi.nlm.nih.gov/35279511/
Teruya K, et al. Activities of curcumin-related compounds in two cell lines persistently infected with different prion strains. Biochim Biophys Acta Gen Subj. 1866(4):130094, 2022
URL:https://pubmed.ncbi.nlm.nih.gov/35065183/
Teruya K, et al. Polymorphisms in glia maturation factor β gene are markers of cellulose ether effectiveness in prion-infected mice. Biochem Biophys Res Commun. 560:105-111, 2021
URL:https://pubmed.ncbi.nlm.nih.gov/33984767/
Ding M, et al. Decrease in skin prion-seeding activity of prion-infected mice treated with a compound against human and animal prions: a first possible biomarker for prion therapeutics. Mol Neurobiol. online ahead of print, 2021
URL:https://pubmed.ncbi.nlm.nih.gov/33983547/
Minikel EV, et al. Prion protein lowering is a disease-modifying therapy across prion disease stages, strains and endpoints. Nucleic Acids Res. 48(19):10615-10631, 2020
URL:https://pubmed.ncbi.nlm.nih.gov/32776089/
