医科学専攻
- Master's Courses
修士課程 - Doctoral Courses
博士課程
Cell Fate Biology and Stem Cell Medicine幹細胞医学
STAFF
Professor
-
Takubo, KeiyoProfessor.M.D. Ph.D. 田久保 圭誉 教授

Other Faculty / Staff
-
Kobayashi, Hiroshi
Assoc. Prof.M.D. Ph.D. 小林 央 准教授 -
Watanuki, Shintaro
Assistant Prof.M.D. Ph.D. 綿貫 慎太郎 助教
CONTACT
TEL:+81-22-717-8150
E-MAIL:keiyo.takubo.e5*tohoku.ac.jp
(「*」を「@」に変換してください)
OUTLINE
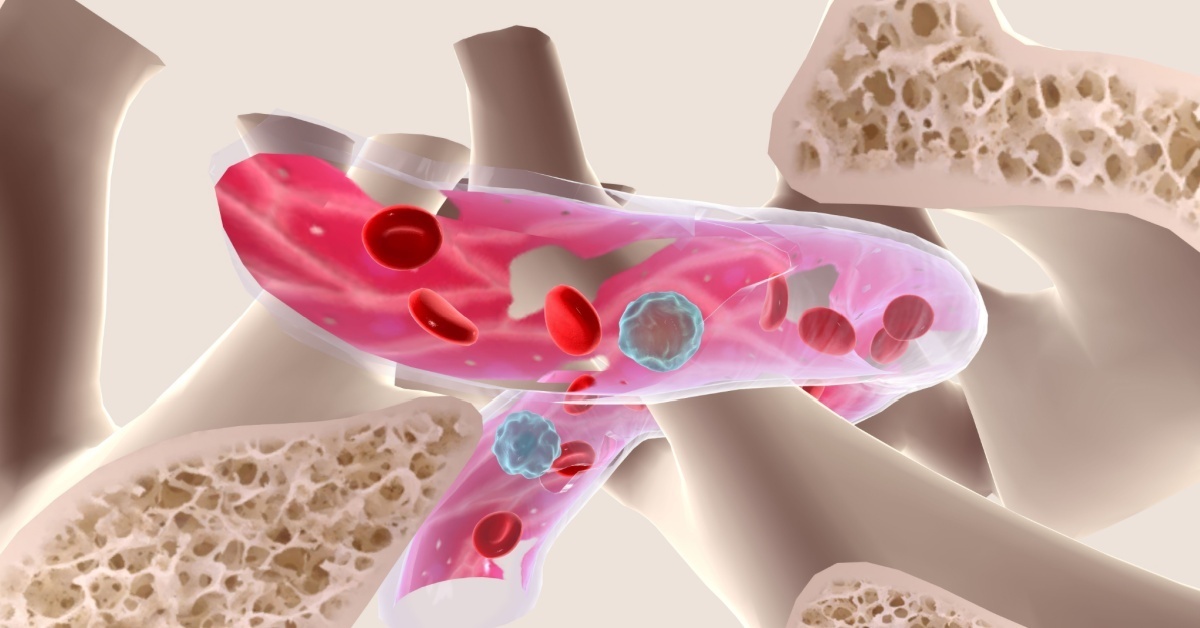
Stem cells are essential for the maintenance and repair of regenerating tissues. However, age- and stress-induced changes in stem cells can lead to tumorigenesis and various diseases. Our research aims to elucidate the intrinsic or extrinsic molecular basis of hematopoietic stem cell (HSC) self-renewal using mouse models and human stem cells. Using advanced technological approaches, including metabolomic analysis, we have shown that quiescent or self-renewing HSCs are in unique metabolic states that are context-specific depending on the microenvironment within the bone marrow, and that metabolic properties are directly involved in cell fate decisions. In response to the consumption of differentiated blood cells, quiescent HSCs are activated to repair the entire blood system (Cell Stem Cell 2010, 2013; Cell Rep 2015; Cell Stem Cell 2016). In recent years, we have characterized the molecular basis of HSCs and niches and their stress-induced changes (Stem Cell Rep 2023; PNAS 2023; Nat Cell Biol 2023) and developed methods to maintain HSCs outside the body and efficiently edit their genome (Cell Rep 2019; Cell Rep Methods 2022).
ヒトのからだを構成する細胞の約三分の二は血液細胞です。私たちの研究室はこの血液細胞がどのように作られて、機能を発揮して、細胞としての寿命を終えていくのかを理解するために研究しています。特に注目しているのは、全ての血液細胞へと分化する能力を持つ造血幹細胞です。造血幹細胞は出生後の哺乳類では、骨の中・骨髄に存在しています。骨髄で造血幹細胞は、近くの環境(ニッチ)によって細胞の未分化状態が保たれていて、必要に応じて増殖・分化して様々な血液細胞を作り出します。これまでに、ニッチは造血幹細胞の代謝状態の調節を通じて細胞運命を決定すること、造血幹細胞とニッチは様々なストレスや加齢によって機能が低下することなどを見出してきました。さらに造血幹細胞とニッチを深く知ることで、様々な病態・疾患や、個体老化のメカニズムも明らかになると考えています。私たちはこのような試みを通じて、生理的・病的な造血幹細胞で作動している分子機構を明らかにして、再生医療につながる幹細胞の維持・増幅・移植技術の開発や、各種の病態や加齢変化の理解、疾患治療法の開発を目指しています。
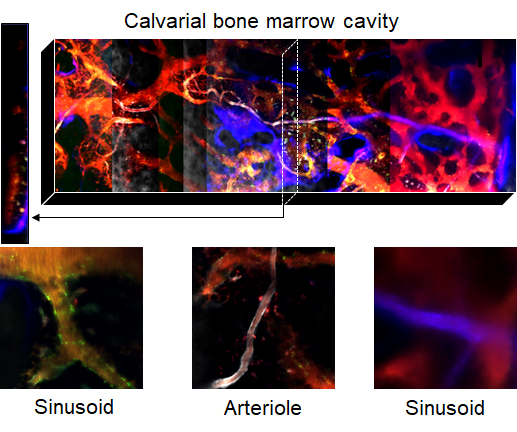
In vivo BM imaging
マウス骨髄の生体イメージング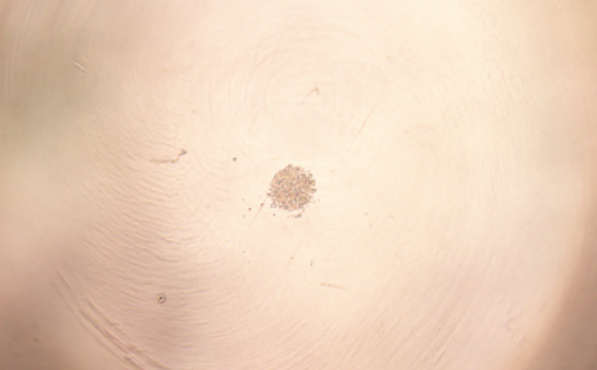
Quiescent HSC culture
造血幹細胞の体外静止期培養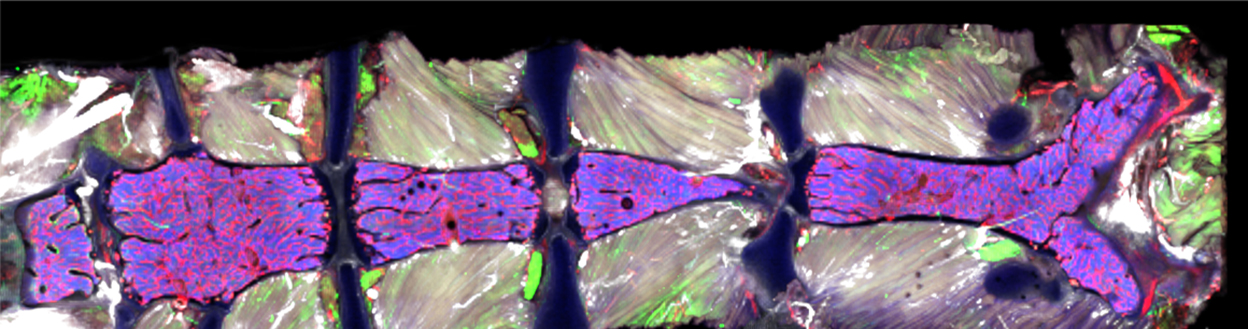
Whole BM imaging of mouse sternum
マウス胸骨の全骨髄イメージング
ARTICLE
Takubo K, et al. MBTD1 preserves adult hematopoietic stem cell pool size and function. Proc Natl Acad Sci U S A. 120(32):e2206860120, 2023
URL:https://doi.org/10.1073/pnas.2206860120
Iga T, et al. Spatial heterogeneity of bone marrow endothelial cells unveils a distinct subtype in the epiphysis. Nat Cell Biol. 25(10):1415-1425, 2023.
URL:https://doi.org/10.1038/s41556-023-01240-7
Sorimachi Y, et al. Mesenchymal loss of p53 alters stem cell capacity and models human soft tissue sarcoma traits. Stem Cell Reports. 18(5):1211-1226, 2023.
URL:https://doi.org/10.1016/j.stemcr.2023.03.009
Shiroshita K, et al. A culture platform to study quiescent hematopoietic stem cells following genome editing. Cell Rep Methods. 2(12):100354, 2022.
URL:https://doi.org/10.1016/j.crmeth.2022.100354
Fujita S, et al. Quantitative Analysis of Sympathetic and Nociceptive Innervation Across Bone Marrow Regions in Mice. Exp Hematol. 112-113:44-59.e6, 2022.
URL:https://doi.org/10.1016/j.exphem.2022.07.297

 加齢による造血幹細胞生着不全の機序を解明 骨髄代謝・血流動態の変容が起因
加齢による造血幹細胞生着不全の機序を解明 骨髄代謝・血流動態の変容が起因
 加齢造血幹細胞にそなわる代謝の柔軟性を発見 ーミトコンドリアの機能向上が生き残りに必要ー
加齢造血幹細胞にそなわる代謝の柔軟性を発見 ーミトコンドリアの機能向上が生き残りに必要ー
 緊急時における造血幹細胞の代謝調節を解明 ―血液細胞システムの緊急再生には解糖系酵素が働いている―
緊急時における造血幹細胞の代謝調節を解明 ―血液細胞システムの緊急再生には解糖系酵素が働いている―