医科学専攻
- Master's Courses
修士課程 - Doctoral Courses
博士課程
Gene Expression Regulation(Institute of Development, Aging and Cancer)遺伝子発現制御(加齢医学研究所)
STAFF
Professor
-
Motohashi, HozumiProfessor. 本橋 ほづみ 教授

Other Faculty / Staff
-
Sekine, Hiroki
Lect. 関根 弘樹 講師 -
Okazaki, Keito
Assistant Prof. 岡崎 慶斗 助教 -
Murakami, Shohei
Assistant Prof. 村上 昌平 助教
CONTACT
TEL:+81-22-717-8550
E-MAIL:hozumim*med.tohoku.ac.jp
(「*」を「@」に変換してください)
OUTLINE
Organisms maintain their lives in the presence of constant interactions with their environments. Most of the environmental factors trigger redox disturbances leading to altered function of biomolecules, which is supposed to results in pathological conditions due to aging. Our main question is what is aging and how we age. Our hypothesis is that impaired environmental response and subsequent smoldering inflammation are one of the important drivers of organismal aging processes. A goal of our research is achievement of healthy aging.
For this goal, we are focusing on the KEAP1-NRF2 system, which plays a major role in our oxidative stress response, and sulfur metabolism, which forms a fundamental basis of biological redox reactions for energy production and signal transduction. Unique reactivity of sulfur is critical for understanding functional mechanisms of the KEAP1-NRF2 system because KEAP1 is a sulfur-based redox sensor, and NRF2 is a sulfur-regulating effector. Sulfur is an only element that catenates by itself. We have recently defined supersulfides as molecules, including metabolites and proteins, that contain catenated sulfur atoms.
Current projects in our lab are as follows.
(1) Exploring a role of supersulfides in cancer malignancy driven by NRF2.
(2) Exploring regulatory mechanisms of mitochondrial function and energy metabolism controlled by NRF2 and supersulfides.
(3) Exploring redox sensors in the nucleus regulating NRF2-mediated transcriptional activation.
(4) Clarifying contributions of supersulfides to epigenetic regulation and gene expression and to regulation of the NRF2 activity.
(5) Clarifying supersulfide contribution to aging process.
すべての生物は環境との相互作用の中でその生命を維持しています。多くの環境要因は、生体の酸化還元反応に影響し、生体分子の変化をもたらし、加齢がもたらす様々な機能低下状態や病的状態につながると考えられています。こうした中で老化の本質が何かと考えた場合、私達は環境応答不全とそれに伴う炎症の持続であるとの仮説をもっています。これらをもたらす分子機構を明らかにするため、酸化ストレス応答の鍵因子である転写因子NRF2やプロテオスタシスの鍵因子である転写因子NRF1による遺伝子発現制御・エピゲノム制御とレドックス代謝制御の切り口から、細胞の核内のイベントにこだわって研究を行っています。そして私達の最終目標は、ヒトの健康長寿の実現に貢献することです。
環境要因とのかかわり合いで鋭敏な変化を受ける生体の酸化還元反応では、イオウ原子がとても重要な役割を果たしています。KEAP1-NRF2制御系は、イオウ原子の反応性を利用したレドックスセンサー分子であるKEAP1と、イオウ代謝のマスター制御因子であるNRF2から構成される重要な生体防御機構で、線虫やショウジョウバエを含む多くの生物の恒常性維持機構を支えています。私達の分野では、加齢に伴い発症頻度が増加するがんや慢性炎症などの疾患の予防・治療に貢献すべく、KEAP1-NRF2制御系と、最近明らかになってきた超硫黄分子(硫黄原子が直鎖状に連結した構造を有する代謝物やタンパク質)を主軸として、生体のレドックス制御における新しい基本原理の発見を目指して研究を展開しています。
主な研究課題は以下の通りです。
(1) NRF2依存性がんにおける超硫黄分子とがん悪性化機構
(2) NRF2と超硫黄分子によるミトコンドリア機能制御とエネルギー代謝
(3) 核内のレドックスセンサーの探索
(4) 超硫黄分子による遺伝子発現制御機構とNRF2の活性制御機構
(5) 個体の老化における超硫黄分子の役割
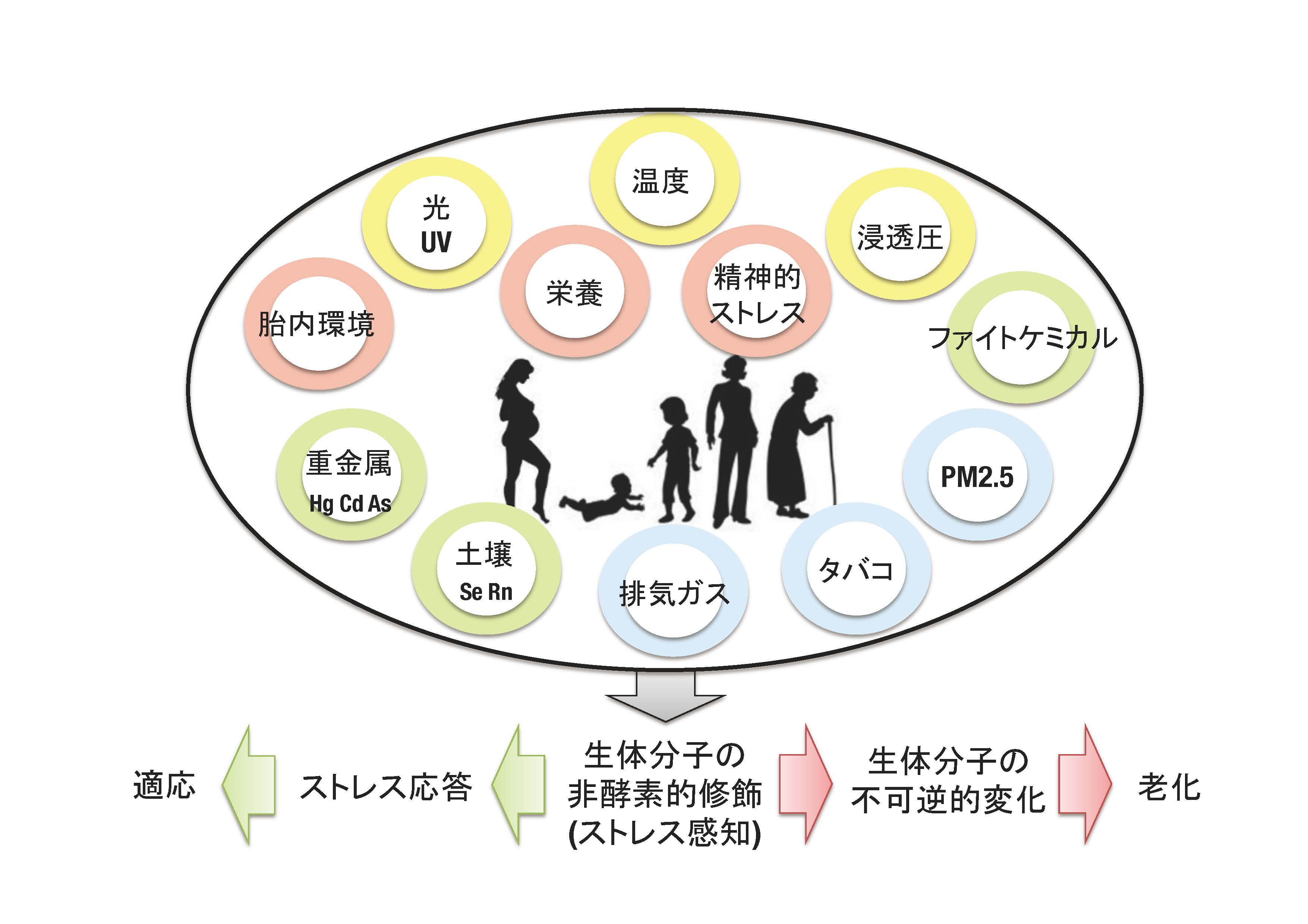
Environmental factors modulate organismal aging processes
ヒトをとりまく様々な環境要因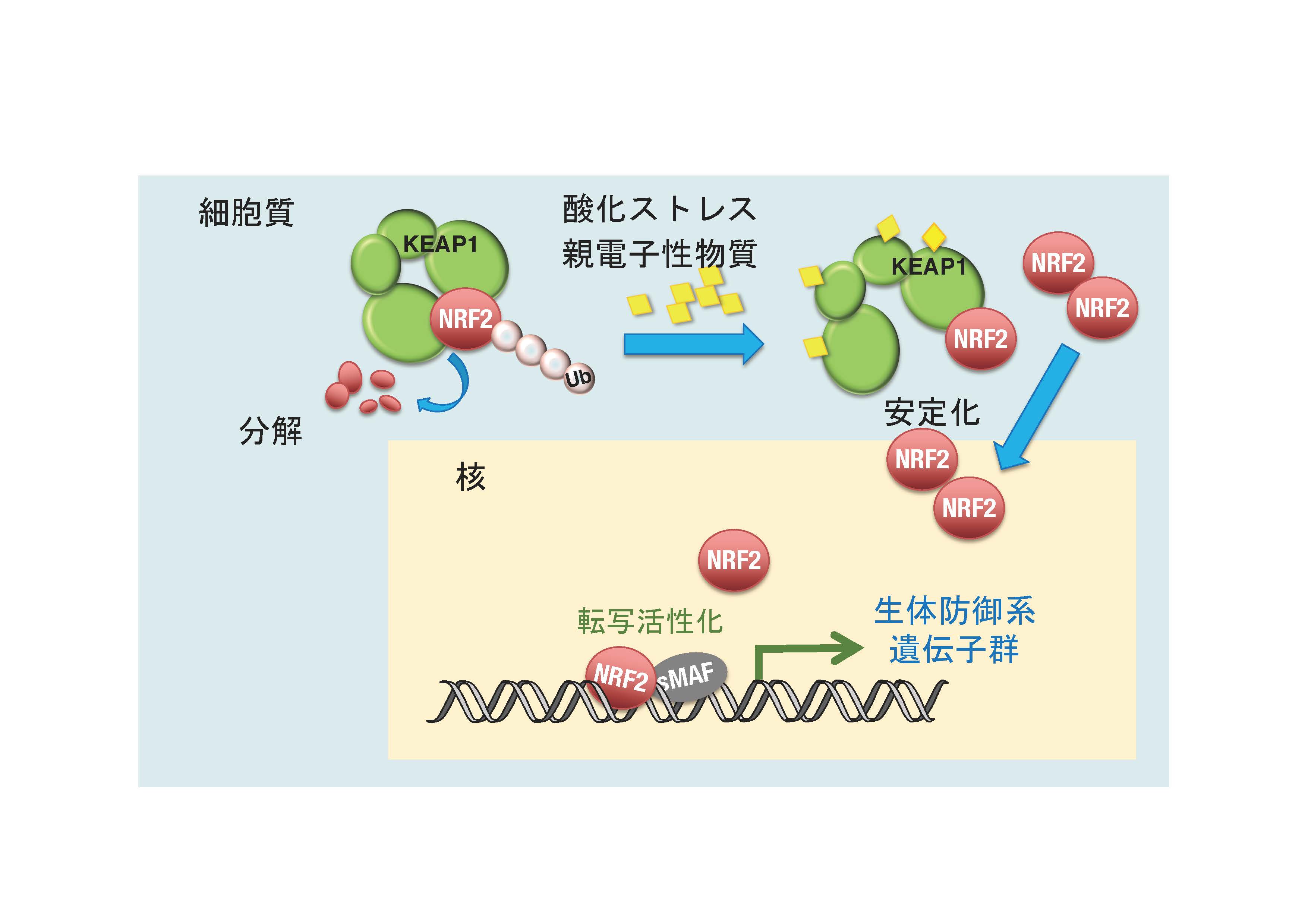
KEAP1-NRF2 system for a defense mechanism against oxidative stress
酸化ストレス応答を担うKEAP1-NRF2制御系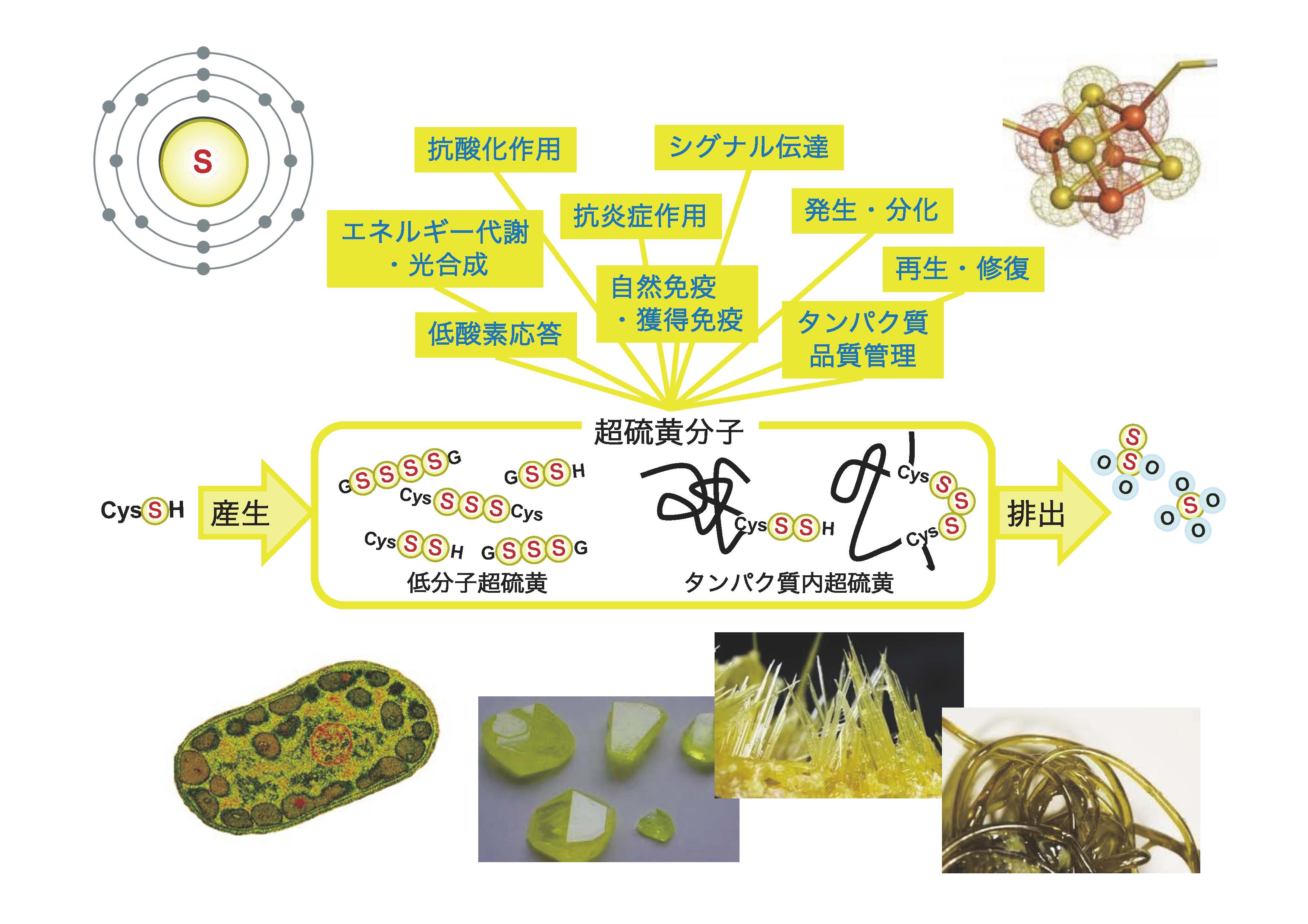
Supersulfides as fundamental biomolecules for life
生体における超硫黄分子の働き
Bits and pieces supporting our science
研究室で出会うものたち
ARTICLE
Marutani E, et al. Sulfide catabolism ameliorates hypoxic brain injury. Nat Commun. 12(1):3108, 2021
URL:https://www.nature.com/articles/s41467-021-23363-x
Okazaki K, et al. Enhancer remodeling promotes tumor-initiating activity in NRF2-activated non-small cell lung cancers. Nat Commun. 11(1):5911, 2020
URL:https://www.nature.com/articles/s41467-020-19593-0
Yamamoto M, Kensler TW, Motohashi H. The KEAP1-NRF2 System: a Thiol-Based Sensor-Effector Apparatus for Maintaining Redox Homeostasis. Physiol Rev. 98(3):1169-1203, 2018
URL:https://journals.physiology.org/doi/full/10.1152/physrev.00023.2017?rfr_dat=cr_pub++0pubmed&url_ver=Z39.88-2003&rfr_id=ori%3Arid%3Acrossref.org
Akaike T, et al. Cysteinyl-tRNA synthetase governs cysteine polysulfidation and mitochondrial bioenergetics. Nat Commun. 8(1):1177, 2017
URL:https://www.nature.com/articles/s41467-017-01311-y
Mitsuishi Y, et al. Nrf2 redirects glucose and glutamine into anabolic pathways in metabolic reprogramming. Cancer Cell. 22(1):66-79, 2012
URL:https://www.sciencedirect.com/science/article/pii/S1535610812002152?via%3Dihub

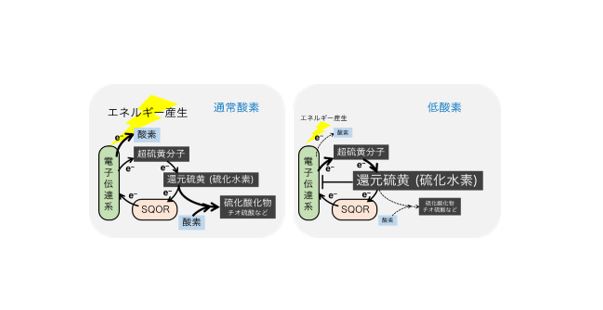 低酸素によって脳障害が起こる新たなメカニズムの解明 脳卒中や心停止に対する治療法開発に期待
低酸素によって脳障害が起こる新たなメカニズムの解明 脳卒中や心停止に対する治療法開発に期待
 免疫細胞の炎症制御「硫黄代謝」がカギ~マクロファージの硫黄代謝を標的とした創薬にむけて~
免疫細胞の炎症制御「硫黄代謝」がカギ~マクロファージの硫黄代謝を標的とした創薬にむけて~